導入事例 4次元細胞シミュレーションで 基礎研究・創薬・医療の研究を加速 ~独自のシミュレーション技術で細胞の本質に迫る~
True Cell Simulations
市川 一寿 様
"第24回目のインタビューは、細胞シミュレーションソフトウェアA-Cell及び細胞シミュレーションのコンサルティングを提供されている株式会社True Cell Simulations の市川 一寿代表取締役社長にお話をお伺いしました。
市川様は、実験と数理解析を融合した革新的な技術により細胞の複雑な仕組みを解析し、医療や創薬の発展に貢献されています。"
この度はよろしくお願いいたします。
早速ですが、事業概要についてご説明いただけますか?
当社の事業には2つ大きな柱があります。ひとつは細胞のモデル構築、シミュレーション、結果の表示を行う「A-Cell」というソフトウェアの開発販売です。もうひとつは細胞シミュレーションのコンサルティングです。
近年、研究の中に細胞シミュレーションを取り入れるというのはずいぶん増えてきました。しかし実験をやっている先生方の大部分は、細胞シミュレーションの存在を知っていても「どうしたら使えるのか」が分からないのです。そこで、コンサルティングをする必要があるだろうと考え、これを事業にすることにしました。本日はA-Cellを中心にお話ししたいと思います。
ありがとうございます。よろしくお願いします。
細胞シミュレーションのお話をするにあたって、まずは細胞についてご説明します。
これは、生物の物質的・機能的階層を図に表したものです。
このように原子が集まって分子となり、分子が沢山集まるとミトコンドリアや核といったオルガネラと呼ばれる構造物ができます。それらが集まったものが細胞になるのです。そして細胞が集まって組織となり、組織が集まって心臓や脳といった臓器になります。そして臓器が集まると個体ができます。動物の体はこのような階層構造になっているのです。生物の階層構造は、物理の階層構造とは違い、階層と階層の間がきれいには分けられません。これはあくまでも概念図になるのですが、この図を元にすると細胞の位置づけができて役立ちます。
御社のコンピュータの販売先は、この階層的概念図で言うところのタンパク質の構造解析といったところが多いのではないかと思いますが、細胞シミュレーションはそれよりは上の階層になります。近年の細胞生物学の研究は下の階層から順に明らかになってきていますので、原子、分子ときたら次のターゲットは絶対「細胞」になるのです。オルガネラを飛び越しましたが、細胞と一緒に考えたいと思います。
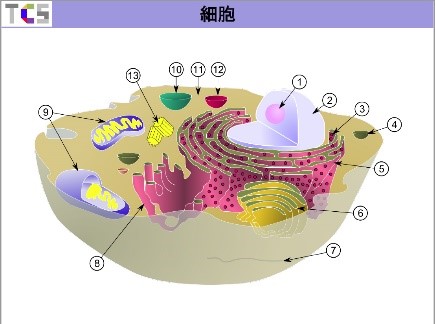
実際の細胞を見たことがある人はほとんどいないと思います。ネットで調べるとこういった図がよく出てきますが、これは見てきたような図なんですよね。本当の細胞の姿はかなり違います。それでも理解するには非常に助かりますので、説明では使います。
このように細胞1個を見ると、細胞膜に覆われており、ミトコンドリアがあり、色々な構造物があります。
それでは、実際の細胞がどうなっているのかお見せします。このようにフニャフニャしています。これはシャーレの上でバラバラにして培養した細胞なのですが、そうすると細胞はアメーバのような不思議な形をとるのです。細胞と細胞が接触するように培養すると、ここまで変な形にはなりません。例えば腸の粘膜の一番上にある上皮細胞を培養すると六角形に近い形になりタイルのように並びます。
培養した細胞を、電子顕微鏡で100枚ぐらいの連続した薄膜切片に切り分け、そこからミトコンドリアや核といったオルガネラを拾ってきて、色分けをし、それを積み上げて再構成したものがこれです。
一見してわかることは、模式的に描かれたよく見る細胞の図とは異なって、非常に複雑な構造をしているということです。
細胞と言いますと丸い卵のような形のイメージでしたが、実際はそうではないんですね。
はい。条件によって細胞は色々な形をとるのです。
それでは、本題に入りますが、パスウェイについてご説明します。
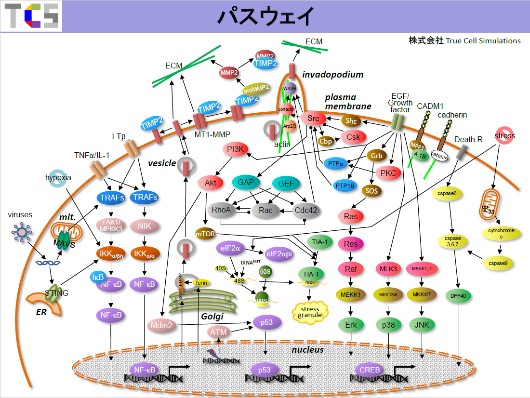
このように細胞膜が外側に、核が内側にあります。そして細胞は常に外側から何らかの信号を受け取るのです。そのために細胞膜の表面には色々な形のタンパク質(受容体タンパク質と呼びます)が発現します。外側からホルモンなどの伝達物質が送られ、細胞表面の受容体タンパク質と結合するとタンパク質の構造が変わって活性化状態になり、その活性化状態がその次のタンパク質を活性化します。それが次々と伝わり最終的には核まで到達します。もちろんすべてが核まで到達するわけではありませんが。
このように細胞の中にはタンパク質同士の相互作用のネットークが沢山あり、これをパスウェイと呼ぶのです。
この研究は、ポストゲノム時代の主要な研究テーマのひとつとなっています。ようするに「どういうタンパク質がどういう関連を持って細胞の機能の基になっているか」ということを研究するのです。これを研究することによってなぜその病気が起こるのか、それを元に戻すにはどうしたら良いのか、といったことを明らかにすることができ、新しい治療法や薬の開発を確実に進めることができるようになります。
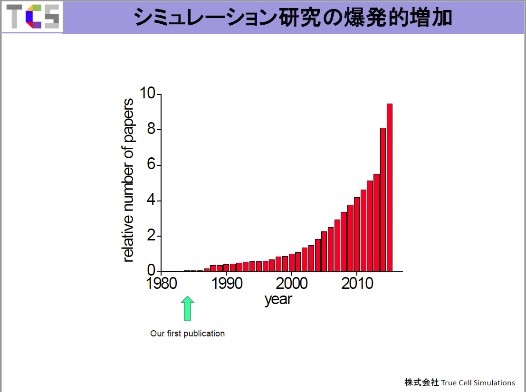
コンピュータを使ったシミュレーションの研究は、2000年代の中頃から急激に増えてきています。
パスウェイとは、物質と物質との化学反応の集合ですから、化学反応式になります。これは最終的には微分方程式に変換できるのです。パスウェイシミュレーションでは、このタンパク質同士の化学反応を微分方程式に落として、それをコンピュータで数値計算して結果を出すということをしています。
最初にパスウェイシミュレーションのようなものが論文になったのは、1963年だったのではないでしょうか。これは電子工学系の研究者によるものでした。その当時、勿論デジタルコンピュータはありましたが、その研究者はなんとアナログコンピュータを使ったのです。要するに積分器や微分器を電子回路で作り、それを微分方程式に合わせて配線するのです。ですから数値積分をするためには微分方程式を見ながら「これとこれが入力で、これとこれを掛け算させて出力させる」というのを配線で組むのです。
このグラフを見ると(シミュレーション研究は)1980年代後半から少しずつ増えてきていますが、2000年代の半ばから急増しています。我々がシミュレーション研究を始めたのは1980年代ですから、最初の頃からやっていることになります。
黎明期からシミュレーションに取り組まれているのですね。それでは、パスウェイシミュレーションに対してA-Cellはどのような特徴があるのでしょうか。
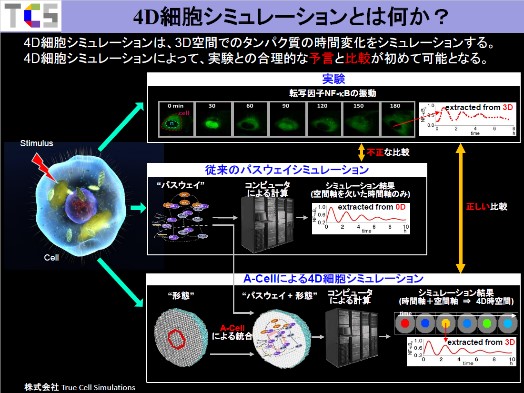
それは4次元細胞シミュレーションであるとこうことです。パスウェイシミュレーションにおいて出力されるものは「タンパク質の濃度の時間変化」です。細胞というのは数十ミクロン程度の小さなものですが、空間があって広がりがあります。細胞の空間的広がりはとても大事なのです。
ここに実験例を挙げていますが、これは癌と大きく関係するタンパク質である転写因子NF-κBを緑色に発光させて、外から刺激を加えた時の挙動を見たものです。
赤い点線で囲った部分が細胞の外側の形で、真ん中の黒く抜けている部分が核です。この写真を見てわかることは、刺激がない時には、NF-κBは核にはないということです。刺激を外から加えると、細胞質が黒くなり、核が緑色になります。これはNF-κBが核に移動したことを示しています。核に移動したらそれで終わりかというと、面白いことにまた細胞質に出るのです。そしてまた核に移動するということを繰り返します。
この核の中の緑色の発光強度を縦軸に、時間を横軸にとると、このように振動します。これはとても興味深いことです。振動の周波数や振動の継続性によって、どういう遺伝子が活性化するかというのが決まると言われています。そのため、振動の周波数と継続の長さといった振動パターンの制御はとても大事なことであると考えられます。遺伝子はタンパク質の設計図と呼ばれていますが、正常な細胞ではどの遺伝子を発現するかが厳密にコントロールされています。しかし癌では、この制御ができなくなっています。がん細胞では外からの刺激に関わりなくNF-κBがいつも活性化しています。それをコントロールしないと、どんなタンパク質もどんどん作ってしまって異常な状態になってしまいます。
細胞は小さいけれども空間があります。少なくとも細胞壁と核は区別しないといけません。ところが、従来のパスウェイシミュレーションではタンパク質の相互作用しかやっていませんので、空間的な区別がありません。
一般に、この(空間的な区別のない)パスウェイシミュレーションと実験を比較して、見た目が合っているので、「(実験と計算が)合っている」と言うのです。しかし、これは不正な比較です。空間があるものとないものを比較するというのはナンセンスです。そこで必要になるのが4次元細胞シミュレーションです。細胞と同じような空間を用意し、その中にパスウェイを入れてシミュレーションをすれば空間を持った同士の比較になりますから、これは正当な比較と言えます。これがA-Cellの一番大きな特徴になります。コンセプトはとても簡単ですが、このようなソフトウェアは世の中にはありません。しかしそれよりも重要なことは、空間の有無によってシミュレーション結果に大きな影響があることです。
どのようにして細胞と同じような空間を用意されるのですか?その空間の影響はどのようなものなのですか?
この“形態”の図を見ていただけますか。四角形に分けられていますよね?これは細胞に限らず流体のシミュレーションなどでも使われる方法ですが、空間を小分けにしてシミュレーションをするのです。
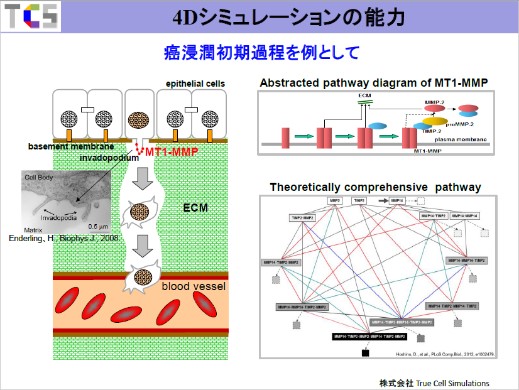
この4次元細胞シミュレーションの能力がどれほどものかを次に示したいと思います。これは癌細胞の浸潤の初期課程を例に挙げたものです。癌というのは怖い病気で、死因の9割以上が転移だと言われています。ですから、これを防ぐことで9割以上の患者さんが延命すると考えられています。
それでは、転移のメカニズムについてご説明します。このように細胞が並んでおり、その下側にbasement membrane(基底膜)やECM(Extracellular Matrix、細胞外マトリックス)があります。これはタンパク質がネットワーク状に繋がったものです。通常、細胞同士はお互いに接着しており、剥がそうとしてもそう簡単には剥がれません。なおかつ基底膜がブロックしているため動かないのです。ところが癌細胞の表面にはinvadopodia(浸潤突起)と呼ばれる突起が出ます。その表面にはMT1-MMPと呼ばれる、基底膜やECMを分解してしまうタンパク質が高発現するのです。そうすると結果として血管の中に侵入し、血管を巡って遠くの臓器に転移するのです。
転移の最初のメカニズムというのは、突起ができてMT1-MMPがECMを分解することになります。したがって、転移を抑えるためにはMT1-MMPがECMを分解できなくしてしまえば良いのです。これは20年以上前からの研究なのですが、その時に考えていたことは「MT1-MMPが出てきても働かないようにする薬を作れば良いではないか」ということです。しかし、それはうまくいきませんでした。その理由はいくつかあるようですが、我々の4次元細胞シミュレーションによってうまくいかない重要な理由が初めて解明されたのです。
この右上の図のピンク色の部分がMT1-MMPです。細胞膜のところにMT1-MMPがいろいろな状態で存在することを示しています。MT1-MMPは癌細胞だけで発現する訳ではありません。しかし、癌細胞では制御が外れているために出続けてしまいます。それを制御するにはMT1-MMPに対してこれを抑制するTIMP-2と呼ばれるタンパク質によって働けなくしてしまう方法があります。もうひとつMMP-2と呼ばれる可溶性のタンパク質がありますが、これもECMを分解する働きがあります。
そこでこれら3つのタンパク質がお互いに組み合わさった複合体を考えます。可能な複合体の組み合わせをすべて書いたのがこれです。これは実はパスウェイなのです。これを使ってパスウェイシミュレーションをしてみました。
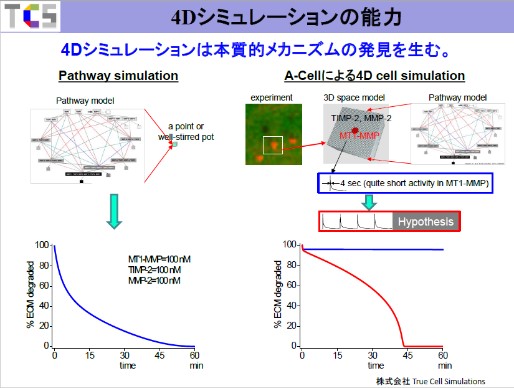
下左図の縦軸はECMが何%残っているかを、横軸は時間を示しています。青線から分かるように大体1時間ぐらいでほぼ分解されていますね。実験と合っています。これは実験と合わせるためにパラメータを選んだ訳ではありません。パラメータは論文が沢山出ていますので、そこから拾ってきたパラメータでやってみた結果です。
右側の図は、それを4次元シミュレーションでやってみた結果です。ここにある画像は癌細胞をシャーレの上で培養して、ECMを緑色に、MT1-MMPを赤に光るように細工したものです。したがって、このオレンジ色の部分はECMとMT1-MMPが重なっているということになります。ところどころ黒く抜けている箇所がありますが、これはECMが分解されて無くなった場所であることを示しています。この写真でわかることは、invadopodiaはそこら中にあるのではなく、まばらにしか無いということです。
そこで白い四角で囲った部分をモデル化し、空間のモデルを作ったものがこの図です。そして左のパスウェイシミュレーションと同じパラメータの値でシミュレーションをしてみました。すると、下右図の青線のように全然ECMが分解されないのです。これは実験とは全く異なっています。これには相当悩みましたが、4次元シミュレーションをやるとMT1-MMPの活性というのは非常に短いということが分かりました。この青枠で囲ったところに山型の小さいグラフがありますが、この縦軸はMT1-MMPの活性です。つまり高いほどECMを分解する能力があるこということを示しています。ところがこれは半値幅がわずか4秒程度なのです。時刻ゼロでMT1-MMPが細胞膜表面に出てきたとしても、わずか4秒で活性が無くなってしまうことを示しています。しかし、左の図を見ていただければ分かるようにECMの分解というのは1時間ぐらい続きます。そのうち4秒しか活性がなければ当然ECMの分解は無理ですよね。
これが分かれば後は簡単で、このように短い活性であるならば何回もMT1-MMPが活性化すれば良いのではないかと考えたのです。これは簡単な話ですよね。そういうシミュレーションをすると分解するのです。
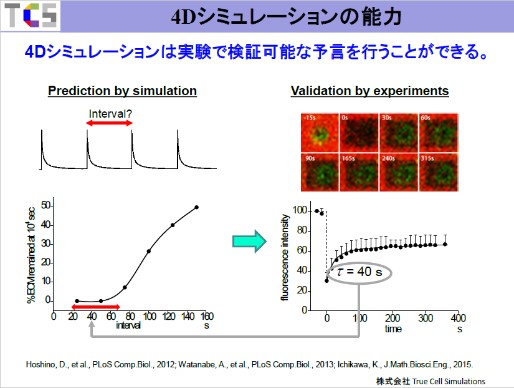
細胞シミュレーションにおいて一番大事なことは「予言をする」ということだと考えています。再現は最低限やらなければなりません。だけれども新しいメカニズムに言及する時には、「もしそうであるならば、こういう現象が起こらなければいけない」ということを予言してあげることが大事です。この研究では、その「予言」をしました。
もし繰り返し発現する必要があるならば、その間隔は何秒ぐらいであるべきかをシミュレーションしてみました。それが左下の図になります。当然ですが、インターバルが長くなるとECMが分解されにくくなっていくことがわかりました。そして実験と合うためにはインターバルが70秒以下でないといけないことがわかりました。
それでは、このインターバルを実験で確かめようということになり、共同研究をしていた実験の方にFRAP(fluorescence recovery after photobleaching, 光褪色後蛍光回復法)を使って解析していただきました。(先ほどお見せした画像と逆転していますが)右上の図の赤はECM、緑がMT1-MMPとなります。この図の上段の2番目(0sの箇所)を御覧ください。黒い四角状に穴が空いていますが、この部分がphotobleachしたところになります。時間経過とともに緑色が段々と戻ってきています。この戻りの光の強さを定量化してグラフにしたものが右下の図になります。この回復の時定数が40秒です。
なぜ実験の回復の時定数40秒と予言の繰り返し周期の70秒以下を比べて良いかといいますと、若干物理(の知識)が必要になりますが、要するにMT1-MMPはランダムに戻ってくるのです。平均40秒でランダムに戻ってくる様子をグラフ化するとエクスポネンシャルカーブになります。ランダム現象とエクスポネンシャルカーブというのは密接な関係があります。ですからこれを比べても良いのです。
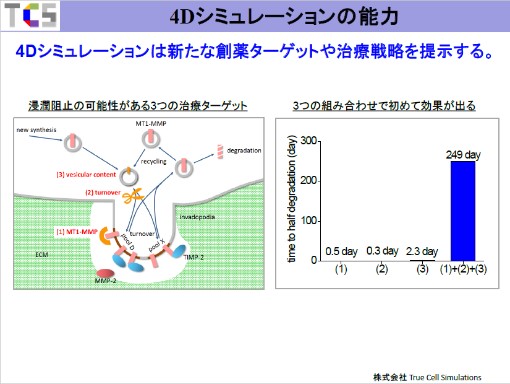
この研究によって、癌の転移を抑えるには3つの方法があることが分かりました。
一つの方法はMT1-MMPをブロックすることです。もう一つの方法はMT1-MMPが繰り返し運ばれるのをストップしてしまうことです。そしてもう一は運ばれるMT1-MMPの量を少なくする方法です。MT1-MMPはタンパク質であり、タンパク質はゴルジ体で修飾されて小胞体という小さな球体に含まれて運ばれます。その球体に含まれるMT1-MMPの量を少なくすることです。
それでは、どれが一番効果的かというのが問いになります。その結果が右のグラフになります。結局、これらの方法の一つだけを抑えてやっても、望むようにはECMの分解を抑えることができないことがわかりました。ところがすべてを組み合わせてやると1年近くECMの分解を延ばすことができるのです。これは患者さん本人にとっても良いことですし、お医者さんにしてみたら治療戦略の選択の時間がとれます。
この結果に至ったのはなぜかと言いますと、ECMを分解するにはMT1-MMPが繰り返しinvadopodiaに現れることが必要であることを見つけたからなのです。そしてなぜそれを見つけることができたかと言いますと4次元細胞シミュレーションをやったからなのです。この結果はパスウェイシミュレーションでは到底到達できないものだったのです。
このように4次元細胞シミュレーションは大事で非常に意味のあるものなのです。
シミュレーションの可能性を感じるお話ですね。分子シミュレーションにおいて溶媒効果を計算するためにQM/MM法という計算手法が開発された背景と共通点を感じました。
なるほど。現象の一部だけを切り取ってシミュレーションをした際には、何かしら結果は出てきますが、いずれは行き詰まってしまいます。その時に「どう打開するか」という方法を考えるという点が共通しているところなのかもしれません。しかし、それはサイエンスの進み方そのものなんですよね。サイエンスというのは必ず仮説に基づく訳です。「こうだ」という仮説に基づいてやってきたことが行き詰まった時、そこでどう打開するかということで次のステップに進むのです。パスウェイシミュレーションも、とことんやって限界が見えてきた時に「ではどうするか」ということで4次元細胞シミュレーションに辿り着くのです。
アインシュタインの相対論が出てきた背景もそうです。ニュートン力学が300年以上前にできて、それで宇宙全体を分かったつもりでいたのですが、色々と観測が進んで調べていくと「これはおかしい」と行き詰まる訳です。そこで近代物理学が出てくると。サイエンスというものはそういう進み方をします。
これは実験研究者向けにシミュレーションの必要性を説明するために作った資料です。
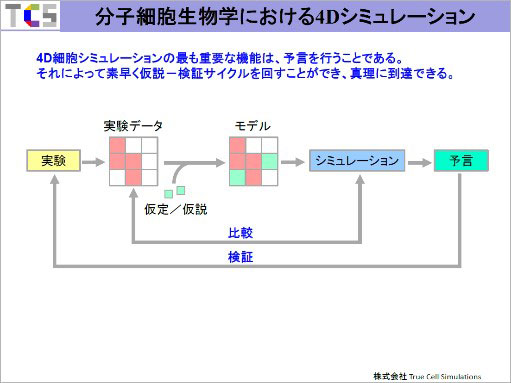
実験をすると色々なデータが出てきます。白い部分も含めて全部で9個のタイルがありますが、このタイル全体が今注目している現象の背後にあるデータだと考えてください。(ここではタイル9個で説明しますが、実際のサイエンスではタイル全体が何個なのかすら分かっていないことが殆どです。)その中で、実験で得られたデータがピンク色のタイルになります。実験データだけでシミュレーションできることは滅多にありません。何らかの仮説を入れ込んで足りないところを補ってモデルを作り、シミュレーションをします。そして出てきたシミュレーション結果を実験データと比較するのです。それだけではありません。シミュレーションでは結果を実験と合わせるだけではなくて「予言」ができるのです。すると、予言が正しいかどうかを検証する必要が出てきます。
パラメータをいくらでも変えられるということがシミュレーションの良いところです。パラメータを変え、色々な状況を作り出して予言を提示するということが素早くできるのです。
科学は「仮説と検証の繰り返し」と聞きますが、そのために予言が重要ということですね。
その通りです。素早く仮説-検証サイクルを回すことで真理に近づいていけると考えています。
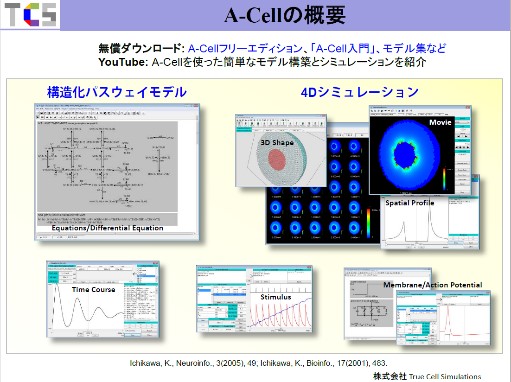
最後にA-Cellの機能について簡単にご説明します。まず、左上に構造パスウェイモデルとありますが、これはパスウェイを構造化して作る機能です。方程式も書けるようになっています。右は4Dシミュレーションとありますが、これがこのインタビューでご説明したA-Cellの一番大きな特徴です。ここに3D Shapeとありますが、三次元の形を作ることができます。右側の図はそれをムービーで表示し、ある時刻を切り取ったものです。その背後の図は、時空間の図を並べたものです。右下のSpatial Profile とあるグラフは、ある時刻の空間プロファイルです。断面をこの上に表示することができ、その断面に沿った濃度の空間プロファイルをとることができます。それからパスウェイシミュレーションの結果はこのようタイムコースを出したり、刺激をモデル化することもできます。神経細胞のことを考えると、電気的な等価回路を扱う必要がありますので、それも実装されています。
UIはJava、シミュレーションはC言語で書いています。素直なC言語プログラムですのでスパコンでも使えます。京コンピュータでも流した実績があります。OpenMP、MPIに対応しており、ラジオボタンで選べるようになっています。
最後に、今後の展望についてお聞かせください。
細胞は数十ミクロンの小さなものですが、非常に複雑なものです。我々人類はまだその本質を理解できていないと思います。ですから、治療や薬の開発が試行錯誤にならざるを得ません。この状態を何とかしようと世界中の研究者が頑張っているわけですが、この中にもっと細胞シミュレーションを採り入れれば研究を加速化できます。A-Cellは私自身が大学などでの研究で必要に迫られて開発し、使って来たものです。それを事業化するために会社を立ち上げましたが、やってみると大学ではできないことができる、という実感があります。もちろん研究を行うなら大学なのですが、サイエンスを進めるための道具立てを提供することは企業の重要な役割です。世界中の研究者にA-Cellを使っていただき、この役割を果たしたいと思っています。
しかしそのためにはA-Cellをさらに発展させなければなりません。現在のA-Cellは4D細胞シミュレーションができるという本質的に重要な機能を持っていますが、実際の細胞の内部構造が非常に複雑であることは、すでにお話しした通りです。しかも細胞の置かれた環境や状況によって、内部構造がダイナミックに変わることが知られており、また病気の細胞や老化した細胞の状態も通常とは異なります。そのうえ、invadopodiaのような細胞局所にあるタンパク質は数えられるほどしかなく、これを濃度で扱うことは適切ではありません。さらに細胞の形も変化します。これらのことすべてをシミュレーションできるようにしたいと思っています。もちろん、見た目が合っているのではなく、確かな根拠に基づくメカニズムを組み込むことが必要です。細胞シミュレーションの最終形態はこのようなものだと考えています。True Cell Simulationsという社名はこれを念頭におきました。ここに向かって活動をして、細胞研究にお役にたつような企業に成長したいと考えています。
なお 弊社ホームページ には無料でダウンロードできる多くの資料をご用意しています。
・ 「10ページで理解するパスウェイシミュレーション」
・ 「10ページで理解する4D細胞シミュレーション」
・ 「10ページで知る細胞シミュレーションの活用法」
・ 「A-Cellを使ったパスウェイシミュレーション ERKシグナル伝達」
・ 「A-Cell入門」
この他に、無償版A-Cellもダウンロードしていただくことができ、さらに各種モデルもダウンロードしていただきことができます。是非ご活用いただけたらと思います。
市川 一寿 様のプロフィール
- 研究者紹介:
市川先生 株式会社 True Cell Simulations 代表取締役社長 - 事業内容:
細胞シミュレーションソフトウエアA-Cell、及び細胞シミュレーションのコンサルティング - 経歴:
1974年 日本アイ・ビー・エム株式会社 研究所
1991年 富士ゼロックス株式会社総合研究所 主任研究員
2001年 富士ゼロックス株式会社中央研究所 脳情報科学研究室室長
2004年 金沢工業大学 生命情報学科 教授
2009年 大阪大学 基礎工学研究科 特任教授
2010年 東京大学 医科学研究所腫瘍数理分野 特任教授
2015年 株式会社 True Cell Simulations設立 代表取締役社長
お問い合わせ
平日9:30~17:30 (土曜日、日曜日、祝祭日、年末年始、夏期休暇は、休日とさせていただきます。)